医院新冠病毒核酸检测实验室管理制度(2020)
2025-10-24
999+
13.49KB
4 页
海报
侵权投诉
XXXX 医院
新冠病毒核酸检测实验室管理制度
(2020)
一、实验室资质要求
二、实验室分区要求
三、主要仪器设备
四、实验室检测程序
1.试剂准备
2.标本前处理
3.核酸提取
4.核酸扩增
五、实验室质量控制与管理
为进一步规范新冠病毒核酸检测实验室工
作,保证实验室工作质量,提高工作效率,满
足新冠病毒核酸检测需求,特制定本制度。
一、实验室资质要求
开展核酸检测的实验室,应当符合《病原微生物实验室生物安全
管理条例》(国务院令第 424 号)和《医疗机构临床基因扩增检验
实验室管理办法》(卫办医政发〔2010〕194 号)有关规定,具备
经过卫生健康行政部门审核备案的生物安全二级及以上实验室条件,
以及临床基因扩增检验实验室条件。独立设置的医学检验实验室还
应当符合《医学检验实验室基本标准(试行)》《医学检验实验室
管理规范(试行)》等要求。
二、实验室分区要求
原则上开展新冠病毒核酸检测的实验室应当设置以下区域:试剂
储存和准备区、标本制备区、扩增和产物分析区。这 3个区域在物
理空间上应当是完全相互独立的,不能有空气的直接相通。各区的
功能是:
1.试剂储存和准备区:贮存试剂的制备、试剂的分装和扩增反
应混合液的制备,以及离心管、吸头等消耗品的贮存和准备。
2.标本制备区:转运桶的开启、标本的灭活,核酸提取及其加
入至扩增反应管等。
3.扩增和产物分析区:核酸扩增和产物分析。
根据使用仪器的功能,区域可适当合并。如采用标本处理、核酸
提取及扩增检测为一体的自动化分析仪,标本制备区、扩增和产物
分析区可合并。
三、主要仪器设备
实验室应当配备与开展检验项目相适宜的仪器设备,包括核酸提
取仪、医用 PCR 扩增仪、生物安全柜、病毒灭活设备(如水浴锅
等 ) 、 保 存 试 剂 和 标 本 的 冰 箱 和 冰 柜 、 离 心 机 、 不 间 断 电 源
(UPS)或备用电源等。
四、实验室检测程序
摘要:
展开>>
收起<<
XXXX医院制定了《新冠病毒核酸检测实验室管理制度(2020)》旨在规范新冠病毒核酸检测实验室工作保证工作质量提高效率。制度要点如下:1实验室资质:需符合相关生物安全及临床基因扩增检验实验室管理规定独立医学检验实验室还应满足特定基本标准和管理规范。2实验室分区:设置试剂储存和准备区、标本制备区、扩增和产物分析区三区物理空间独立功能明确根据仪器功能区域可适当合并。3仪器设备:配备核酸提取仪、PCR扩增仪等适宜设备。4检测程序:包括试剂准备、标本前处理、核酸提取、核酸扩增等步骤并建立可疑和阳性标本复检流程。5质量控制与管理:加强核酸检测质量控制做好性能验证和日常室内质控常态化接受国家级或省级检验质量控制不合格者不得开展检测同时涵盖人员培训、标本管理、试剂选择等多方面质量管理。
相关推荐
-
妇科诊疗技术操作标准规范_20622084

 2025-11-29 999+
2025-11-29 999+ -
妇科诊疗常规(已审)_20625126

 2025-11-29 999+
2025-11-29 999+ -
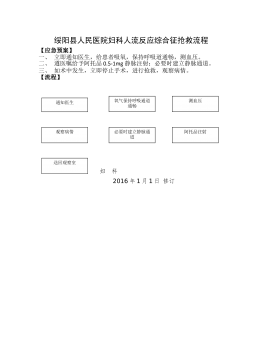
妇科人流综合症应急预案及流程_20622076
 2025-11-29 999+
2025-11-29 999+ -
妇科检查及二合诊三合诊图解_20622068

 2025-11-29 999+
2025-11-29 999+ -
妇科检查规范_20622067

 2025-11-29 999+
2025-11-29 999+ -
妇科护理常规讲解_20625121

 2025-11-29 999+
2025-11-29 999+ -
妇科护理常规_20622061

 2025-11-29 999+
2025-11-29 999+ -
妇科 不孕病(多囊卵巢综合征)中医临床路径_20625117

 2025-11-29 999+
2025-11-29 999+ -
二级病原微生物试验室生物安全管理规范-上海卫生和计划生育_20621748

 2025-11-29 999+
2025-11-29 999+ -
2022子宫内膜异位症【29页】

 2025-11-29 999+
2025-11-29 999+



