医疗器械召回管理制度
2025-10-21
999+
34.5KB
2 页
海报
侵权投诉
医疗器械有限公司 文件编号 XXX-WI-QM01-2016
受控状态 受控 版本号 B/0
文件名称 医疗器械召回管理制度 生效日期 页 次2
第一章 总则
第1条 目的
对已交付客户的(含最终客户)的批量不合格品进行控制,将不合格品对客户造成的
影响降低到最低限度,为达成上述目标特制订本制度。
第2条 适用范围
适用于公司根据法规及供方的要求,需要进行召回的产品。
第 3 条 权责
1.销售部门:负责与顾客联系,实施召回。
2.质量部:负责根据公司的要求,向相关监管机构呈报。
第二章 工作程序
第4条 医疗器械召回定义:
医疗器械召回是指医疗器械生产企业按照规定的程序对其已上市销售的存在缺陷的某
一类别、型号或者批次的产品,采取警示、检查、修理、重新标签、修改并完善说明书、
软件升级、替换、收回、销毁等方式消除缺陷的行为。
第5条 医疗器械的判定标准
1.一级召回:使用该产品可能或者已经引起严重健康危害的;
2.二级召回:使用该产品可能或者已经引起暂时的或者可逆的健康危害的;
3.三级召回:使用该产品引起危害的可能性较小但仍需要召回的。
一级召回在1日内;二级召回在3日内;三级召回在7日内,通知到有关医疗器械经营企
业、使用单位或者告知使用者。
第6条 医疗器械召回流程
1.产品召回
a) 主动召回:通过信息的收集整理、分析评估,根据使用风险的严重程度,在未接到
官方要求强制召回的情况下主动对存在使用风险的产品进行召回的行为。
b) 强制召回:经上级监督管理部门通过评估,认为存在安全隐患,公司应当召回产品
确未进行召回的,监管部门有权责令企业进行产品召回。
2.产品召回的实施
a) 质管部负责召回医疗器械的信息收集、管理及发布召回通知,销售部负责召回已
摘要:
展开>>
收起<<
医疗器械有限公司文件《医疗器械召回管理制度》(编号XXXWIQM012016版本号B0)规定了医疗器械召回的管理要求。该制度旨在控制已交付客户的批量不合格品降低其对客户的影响。制度适用于公司根据法规及供方要求需召回的产品明确了销售部门负责与顾客联系实施召回质量部负责向监管机构呈报的权责。制度将召回分为一级(可能或已引起严重健康危害)、二级(可能或已引起暂时或可逆健康危害)、三级(引起危害可能性较小但仍需召回)三个等级并规定了不同等级召回的通知时限。召回流程包括主动召回和强制召回两种方式质管部负责信息收集、管理及发布召回通知销售部、采购部、库房等部门协同实施召回。制度还规定了召回产品的处理、记录及召回效果评价等要求并附有相关文件和记录表格。
相关推荐
-
妇科诊疗技术操作标准规范_20622084

 2025-11-29 999+
2025-11-29 999+ -
妇科诊疗常规(已审)_20625126

 2025-11-29 999+
2025-11-29 999+ -
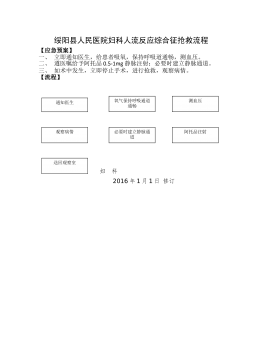
妇科人流综合症应急预案及流程_20622076
 2025-11-29 999+
2025-11-29 999+ -
妇科检查及二合诊三合诊图解_20622068

 2025-11-29 999+
2025-11-29 999+ -
妇科检查规范_20622067

 2025-11-29 999+
2025-11-29 999+ -
妇科护理常规讲解_20625121

 2025-11-29 999+
2025-11-29 999+ -
妇科护理常规_20622061

 2025-11-29 999+
2025-11-29 999+ -
妇科 不孕病(多囊卵巢综合征)中医临床路径_20625117

 2025-11-29 999+
2025-11-29 999+ -
二级病原微生物试验室生物安全管理规范-上海卫生和计划生育_20621748

 2025-11-29 999+
2025-11-29 999+ -
2022子宫内膜异位症【29页】

 2025-11-29 999+
2025-11-29 999+



