医疗器械追踪溯源管理制度
2025-10-21
999+
10.67KB
1 页
海报
侵权投诉
文件名称:医疗器械追踪溯源管理制度 编号:
起草部门: 起草人: 审阅人: 批准人:
起草日期: 批准日期: 执行日期: 版本号:
1. 目的:
为保证医疗器械使用安全、有效,保证人民健康和生命安全,在发生医
疗器械不良事件时,能够第一时间找到患者,追溯医疗器械的历史,特
制定本制度。
2. 依据:
《医疗器械监督管理条例》、《医疗器械监督管理办法》、《医疗器械经营
质量管理规范》等法律法规。
3. 范围:
适用于本公司内各个环节内的质量投诉、事故调查和处理报告的处理程序。
4. 责任:
质量管理机构负责对本制度的监督执行。
5.内容:
5.1.医疗器械可追溯性,就是对医疗器械原料及部件来源、产品加工情况、
销售情况、使用情况进行追踪,可追溯到每个具体的植入性、介入性医疗器械
生产情况、销售情况、使用情况,明确使用患者的情况及由此产生的不良反应。
5.2.对于植入性、介入性高风险医疗器械,在管理类别上均属三类
医疗器械,是要求从生产、经营到使用进行全程追踪的器械,以序列号为追
溯主线和识别关键,对每个器械进行追溯。
5.3.三类医疗器械的可追溯方式是医疗机构主要采用到生产的自下而上的追
溯方式,也就是从患者——使用单位——经营公司——生产厂家的追溯方式。
这种方式适合于使用终端发现了产品问题后层层追溯查明原因,或者是向上追
溯查明产品是否属假冒或重复使用等情形。
5.4.对于不植入人体但风险较高的器械,如一次性使用注射器等。这类产品
是以批号为识别关键,一般不为每个单独的器械编上序列号,仅以批号为追溯
主线。
5.5.对于某些成批生产的植入性或介入性医疗器械,在标示批号的同时,还
为其加上一个独特的序列号,这样就做到了序列号和批号相结合的追溯方式。
5.6.对高风险医疗器械的经营进行详细的记录存档。记录内容应包括:产品
品名、规格、型号、批号、生产厂商等内容。
摘要:
展开>>
收起<<
医疗器械追踪溯源管理制度摘要1目的:保证医疗器械使用安全有效保障人民健康生命安全发生不良事件时能第一时间找到患者、追溯历史。2依据:依据《医疗器械监督管理条例》等法律法规制定。3范围:适用于公司内各环节质量投诉、事故调查和处理报告程序。4责任:质量管理机构监督执行。5内容:医疗器械可追溯性涵盖原料部件来源、加工、销售、使用等情况;植入性、介入性高风险三类医疗器械以序列号为追溯主线全程追踪;三类医疗器械采用自下而上追溯方式;不植入人体但风险较高的器械以批号为追溯主线;成批生产的植入或介入器械采用序列号和批号结合追溯;对高风险医疗器械经营详细记录存档含产品品名、规格、型号等信息。
相关推荐
-
妇科诊疗技术操作标准规范_20622084

 2025-11-29 999+
2025-11-29 999+ -
妇科诊疗常规(已审)_20625126

 2025-11-29 999+
2025-11-29 999+ -
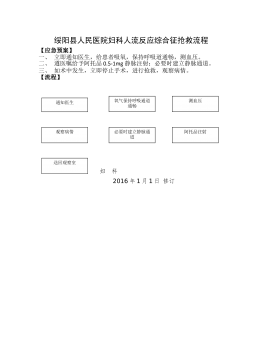
妇科人流综合症应急预案及流程_20622076
 2025-11-29 999+
2025-11-29 999+ -
妇科检查及二合诊三合诊图解_20622068

 2025-11-29 999+
2025-11-29 999+ -
妇科检查规范_20622067

 2025-11-29 999+
2025-11-29 999+ -
妇科护理常规讲解_20625121

 2025-11-29 999+
2025-11-29 999+ -
妇科护理常规_20622061

 2025-11-29 999+
2025-11-29 999+ -
妇科 不孕病(多囊卵巢综合征)中医临床路径_20625117

 2025-11-29 999+
2025-11-29 999+ -
二级病原微生物试验室生物安全管理规范-上海卫生和计划生育_20621748

 2025-11-29 999+
2025-11-29 999+ -
2022子宫内膜异位症【29页】

 2025-11-29 999+
2025-11-29 999+



