医疗器械质量控制和放行指南
《附件医疗器械生产企业质量控制与成品放行指南》摘要医疗器械生产企业需按《医疗器械生产质量管理规范》要求强化产品实现全过程尤其是采购与生产环节的质量控制及成品放行管理确保产品合规。一、适用范围涵盖产品相关原材料、零部件等验证确认及质量管理不包括采购物品、中间品放行程序也不涉及环境、设施、设备等的质量控制与管理(与产品直接相关的除外)。二、质量控制与成品放行1采购控制与进货检验:建立采购控制程序参照供应商审核指南管理供应商。确定主要原材料等的验证确认程序制定进货检验规程记录接收拒收情况。2过程控制与过程检验:确定中间品、生产过程控制程序建立过程检验规程记录相关情况。对关键工序验证、特殊过程确认必要时确认软件实施过程检验与参数监视。3成品检验与成品放行:制定成品检验规程记录相关情况。建立成品放行程序明确放行条件与批准要求放行前需满足多项条件。4其他要求:波动影响大的验证项目纳入常规控制常规控制项目一般不委托检验。确定指标和方法优先采用国标、行标必要时验证确认内控标准。企业原则上不得采用有问题的放行标准确需采用需严格管理。建立数据分析程序定期评审质量控制与放行控制。三、术语对验证、确认、关键工
相关推荐
-
妇科诊疗技术操作标准规范_20622084

 2025-11-29 999+
2025-11-29 999+ -
妇科诊疗常规(已审)_20625126

 2025-11-29 999+
2025-11-29 999+ -
妇科人流综合症应急预案及流程_20622076
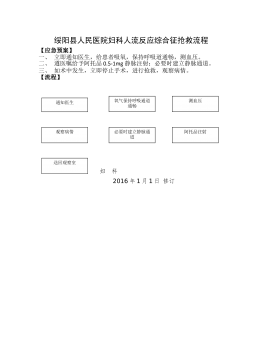
 2025-11-29 999+
2025-11-29 999+ -
妇科检查及二合诊三合诊图解_20622068

 2025-11-29 999+
2025-11-29 999+ -
妇科检查规范_20622067

 2025-11-29 999+
2025-11-29 999+ -
妇科护理常规讲解_20625121

 2025-11-29 999+
2025-11-29 999+ -
妇科护理常规_20622061

 2025-11-29 999+
2025-11-29 999+ -
妇科 不孕病(多囊卵巢综合征)中医临床路径_20625117

 2025-11-29 999+
2025-11-29 999+ -
二级病原微生物试验室生物安全管理规范-上海卫生和计划生育_20621748

 2025-11-29 999+
2025-11-29 999+ -
2022子宫内膜异位症【29页】

 2025-11-29 999+
2025-11-29 999+



