干细胞治疗糖尿病的研究近况
标签: #糖尿病
摘要本文综述了本世纪以来干细胞治疗糖尿病的研究进展包括胰岛的体内发育、分化及其标志物以及利用胰导管干细胞和胚胎干细胞定向诱导分化为胰岛对糖尿病进行细胞治疗的实验。全球糖尿病患者数量庞大DM发病机制复杂目前治疗以药物和注射胰岛素为主但胰岛移植因组织来源匮缺而受限干细胞定向诱导分化成胰岛成为研究热点。在胰岛形成过程中内胚层细胞形成小导管部分细胞团发育为外分泌腺泡一些细胞群发育成具有内分泌功能的胰岛。胰岛细胞分化受多种因素调节如PDX1是胰腺发育及胰岛素基因转录表达的关键性转录因子ngn3与胰岛分化密切相关。近年研究揭示了胰岛前体细胞的特异性标记物如酪氨酸羟化酶、葡萄糖转运子2等。诱导干细胞分化为胰岛的研究中胰导管干细胞和胚胎干细胞是主要来源但将这些细胞诱导成胰岛仅处于实验室研究初级阶段。
相关推荐
-
妇科诊疗技术操作标准规范_20622084

 2025-11-29 999+
2025-11-29 999+ -
妇科诊疗常规(已审)_20625126

 2025-11-29 999+
2025-11-29 999+ -
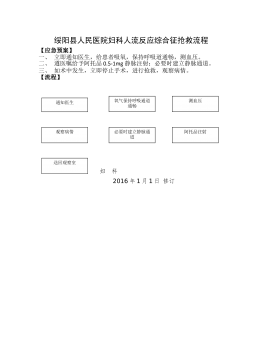
妇科人流综合症应急预案及流程_20622076
 2025-11-29 999+
2025-11-29 999+ -
妇科检查及二合诊三合诊图解_20622068

 2025-11-29 999+
2025-11-29 999+ -
妇科检查规范_20622067

 2025-11-29 999+
2025-11-29 999+ -
妇科护理常规讲解_20625121

 2025-11-29 999+
2025-11-29 999+ -
妇科护理常规_20622061

 2025-11-29 999+
2025-11-29 999+ -
妇科 不孕病(多囊卵巢综合征)中医临床路径_20625117

 2025-11-29 999+
2025-11-29 999+ -
二级病原微生物试验室生物安全管理规范-上海卫生和计划生育_20621748

 2025-11-29 999+
2025-11-29 999+ -
2022子宫内膜异位症【29页】

 2025-11-29 999+
2025-11-29 999+



