《证候类中药新药临床研究技术指导原则》(2018)
2025-10-13
999+
28KB
11 页
海报
侵权投诉
关于发布证候类中药新药临床研究技术指导原则的通告(2018
年第 109 号) 2018 年 11 月 06 日 发布
为继承和发扬中医药诊疗特色和优势,完善符合中药特点的技术评价体系,落
实《药品注册管理办法》《中药注册管理补充规定》的相关规定,国家药品监督管
理局组织制定了《证候类中药新药临床研究技术指导原则》,现予发布。
特此通告。
附件:1.证候类中药新药临床研究技术指导原则
2.《证候类中药新药临床研究技术指导原则》起草说明
附件 1
证候类中药新药临床研究技术指导原则
证候(简称证)是对疾病(泛指非健康)发展到一定阶段
的病因、病性、病位及病势等的高度概括,具体表现为一组有
内在联系的症状和体征,是中医临床诊断和治疗的依据。为了
更好地传承和发扬中医药特色和优势,国家药品监督管理局根
据药品注册相关法规,特制定《证候类中药新药临床研究技术
指导原则》(以下简称《指导原则》)。
证候类中药新药是指主治为证候的中药复方制剂新药。
《指导原则》旨在为证候类中药新药临床试验的开展和有效
性、安全性评价提供基础性指导,其正文内容中的每一个原则
性要求都可以随着后续研究的不断深入,进一步丰富和发展为
更详实具体的技术标准。
一、证候类中药新药的处方来源及基本要求
证候类中药新药的处方应来源于临床实践,符合中医药理
论,体现理、法、方、药相一致的原则。证候类中药新药申请
临床试验应有充分的人用历史证明性文献材料,包括处方来
源、组方合理性、临床应用情况(包括提供临床实践完善处方
的演变过程)、功能主治、用法用量等相关内容。如拟开发的
证候类中药新药是来源于中医临床经验的积累,针对临床常见
基本证候的,应提供相关证明;如是源于医案中对比分析研究
所发现的相对成熟有效的处方,应提供典型医案和系列医案;
如具有一定临床研究基础且有相应数据证明的成熟有效的处
方,应提供相关临床研究总结报告,该总结报告应明确具体中
医证候、疗效特点和安全性信息;如是源于国家科技立项的临
床研究成果,应提供临床研究部分的总结资料及相关的成果鉴
定材料。
证候类中药新药立项开发时,应注意评估与已上市同类药
品的临床价值差异,以明确其是否具备临床开发价值。
二、证候类中药新药的临床定位
证候类中药新药临床应定位于消除、改善或控制具有内在
关联性的一组疾病的主要临床症状、体征等,也可定位于通过
证候改善达到疾病治疗等目的。
三、证候类中药新药的证候诊断
拟开发新药的中医证候确定应有与之相关的临床实践基
础,并应遵循中医药理论。
中医证候诊断标准可以参照有关国家标准、行业标准或团
体标准等进行制定,如无适用的诊断标准,可自行制定并经专
家论证达成共识。证候诊断构成要素可采用定性或半定量方
式,或主次症的方法,鼓励制定具有中医特色的证候诊断量
表,并可根据具体研究内容辅以客观诊断指标。
四、证候类中药新药的基本研究思路及试验设计
(一)基本研究思路
证候类中药新药临床研究可有多种模式,如单纯中医证候
研究模式、中医病证结合研究模式或中医证统西医病的研究模
式,无论何种研究模式,证候类中药新药研究均应对所研究证
候的动态变化规律及相关西医疾病所处特定阶段要有明确的界
定。
1.单纯中医证候研究
选择符合某个中医证候诊断标准的适应人群进行研究,观
摘要:
展开>>
收起<<
关于发布证候类中药新药临床研究技术指导原则的通告摘要2018年11月06日为发扬中医药优势完善中药技术评价体系国家药品监督管理局发布了《证候类中药新药临床研究技术指导原则》。该原则旨在为证候类中药新药临床试验及评价提供基础性指导并随研究深入进一步丰富。证候类中药新药指主治为证候的中药复方制剂新药其处方应源于临床符合中医药理论。申请临床试验时需提供充分的人用历史证明性文献材料。新药临床可定位于消除、改善疾病症状或通过证候改善达到治疗目的。证候诊断应有临床实践基础可参照相关标准制定。研究模式多样均需明确界定证候动态变化规律。设计时需合理制定纳入与排除标准确证性研究应遵循随机、双盲等原则。同时要根据药物特点和前期信息合理设置观测时点及疗程科学设计随访。有效性评价应采用公认标准重视临床价值评估。安全性评价需结合疾病检查与安慰剂或阳性药对照。此外通告还强调了信息采集、数据管理的重要性并规定了研究人员资质和说明书撰写原则。
相关推荐
-
妇科诊疗技术操作标准规范_20622084

 2025-11-29 999+
2025-11-29 999+ -
妇科诊疗常规(已审)_20625126

 2025-11-29 999+
2025-11-29 999+ -
妇科人流综合症应急预案及流程_20622076
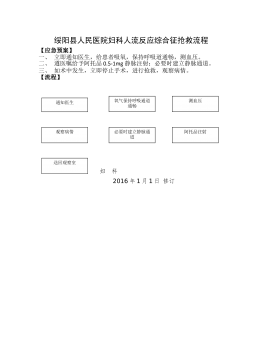
 2025-11-29 999+
2025-11-29 999+ -
妇科检查及二合诊三合诊图解_20622068

 2025-11-29 999+
2025-11-29 999+ -
妇科检查规范_20622067

 2025-11-29 999+
2025-11-29 999+ -
妇科护理常规讲解_20625121

 2025-11-29 999+
2025-11-29 999+ -
妇科护理常规_20622061

 2025-11-29 999+
2025-11-29 999+ -
妇科 不孕病(多囊卵巢综合征)中医临床路径_20625117

 2025-11-29 999+
2025-11-29 999+ -
二级病原微生物试验室生物安全管理规范-上海卫生和计划生育_20621748

 2025-11-29 999+
2025-11-29 999+ -
2022子宫内膜异位症【29页】

 2025-11-29 999+
2025-11-29 999+



